在近日落下帷幕的2024中国营养师发展大
胰腺导管腺癌是一种恶性程度高、诊断难度大的癌症。由于高耐药性和转移性,缺乏可靠的生物标志物或早期诊断方法,亟需新的研究模型。日本东京大学的研究人员在《Cell Reports》(影响因子8.8)刊文,表示他们可以利用iPSC衍生的间充质干细胞融合患者来源的肿瘤细胞,生成全新的胰腺癌类器官。这个类器官高度模拟患者体内的肿瘤微环境,有望加速抗癌药物筛选,为患者实现个性化诊疗带来新希望。
“癌症之王”胰腺癌,被认为是一种侵袭性极强的癌症。其中,来源于胰腺上皮细胞的胰腺导管腺癌(PDAC)是最普遍、最具侵袭性的,约占胰腺癌的90%。
目前,手术切除仍是部分PDAC患者的唯一治愈希望,但预后较差,5年生存率仅为10%。由于诊断延迟、化疗耐药、转移性高,尚缺乏可靠的生物标志物或早期诊断方法,很难将病灶全部切除。
因此亟需一种新的研究模型,模拟其异质性肿瘤微环境,测试抗癌药物的耐药性。
近日,来自日本东京大学的研究人员在《Cell》子刊发表了最新研究成果[1]:他们利用人诱导多能干细胞衍生的间充质干细胞,融合了患者来源的胰腺导管腺癌细胞,生成一种全新的胰腺癌类器官(FPCO)。
这种创新融合方式,产生了两种不同的胰腺癌类器官,可高度模拟患者的肿瘤组织和独特的肿瘤微环境,有助于抗癌药物的筛选,有望促进癌症生物学和个性化医疗的深入研究。

△ 融合hiPSC的基质细胞会产生具有异质性成纤维细胞的胰腺癌类器官,有望加速抗癌药物筛选,促进胰腺癌深入研究。
01
iPSC+类器官
创新融合胰腺癌类器官
胰腺导管腺癌这种高死亡率与其独特的肿瘤微环境息息相关。
肿瘤微环境(TME, tumor microenvironment)对肿瘤的发生、进展以及治疗效果具有重要作用。而胰腺导管腺癌的TME特征存在于复杂的基质结构,包括癌症相关成纤维细胞(CAFs),肿瘤内皮细胞(TECs)以及多种免疫细胞。其中,成纤维细胞是主要参与癌细胞整体侵袭性和扩散的特定细胞,可以促进PDAC的进展和化学耐药性。
为了评估抗癌候选药物在体外的有效性,研究不同类型的成纤维细胞,当务之急是开发一个胰腺导管腺癌的细胞培养系统,模拟独特的肿瘤微环境。
与传统的2D细胞培养模型不同,利用类器官技术模拟胰腺癌生长的肿瘤微环境更具有复杂性。同时,由于用于类器官培养的成纤维细胞(CAFs)的分化潜能有限,对如何培养有异质性的CAFs提出了挑战。
科学家们大胆决定用分化潜能更强的人诱导多能干细胞(hiPSC)。经由hiPSC衍生的间充质干细胞(MSC)作为类器官来源之一,希望其多谱系分化潜力能在类器官中产生异质性CAFs。
该研究在几种不同培养技术的共同作用下,最终生成2种不同的胰腺癌类器官(Fused pancreatic cancer organoids,FPCO),其肿瘤微环境包含有不同功能的成纤维细胞,通过单细胞RNA基因测序(scRNA-seq),进一步表明了CAFs的异质性。
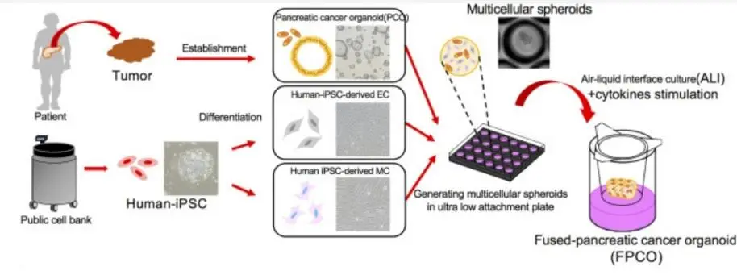
△ 利用iPSC、细胞球体共培养和气液界面(ALI)技术,形成适合胰腺癌细胞的导管状结构,最后融合而成2种胰腺癌类器官。
这两种不同类型的胰腺癌类器官,一种是增殖性的(pFPCO),一种是静止性的(qFPCO),且这两种类型的FPCO类似于典型患者肿瘤组织的不同部分。

△ pFPCO和qFPCO形成的组织包括癌细胞的管腔结构和丰富的基质,它们类似于临床患者和异种移植物的组织。
鉴于此,研究人员进一步对这两种不同的pFPCO和qFPCO以及常规胰腺癌类器官(PCO)分别进行了抗癌药物的耐药性测试,以确认创新融合而成的胰腺癌类器官(FPCO)中人工的肿瘤微环境对抗癌药物敏感性的影响。
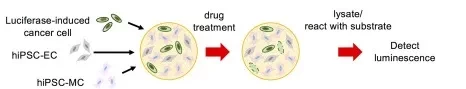
加入不同浓度的抗癌药物(吉西他滨、5-氟尿嘧啶(5-FU)和紫杉醇)后,在qFPCO和PCO中未观察到抗癌药物治疗后的再增殖,而在pFPCO中,药物治疗后1周癌细胞数量增加。
研究结果表明,增殖性的胰腺癌类器官(pFPCO)是一种有效的肿瘤类器官模型,并可能为开发可以抑制PDAC复发的癌症疗法提供检测系统。

△ 增殖性的胰腺癌类器官(pFPCO)表现出了抗癌药物的耐药性。
本研究论文的共创作者Tanimizu Naoki博士总结道,“目前,胰腺导管腺癌的抗癌药物在临床试验阶段都以失败告终。因此,具有独特肿瘤微环境特征的胰腺癌类器官的出现,应用于抗癌药物的筛选。增殖性胰腺癌肿瘤类器官呈现出的耐药性及增殖潜能,或将促进学界对PDAC癌种研究的深入开展,以及与之对应的肿瘤患者个性化医疗的未来研究。”
02
肿瘤类器官推开
患者个体化治疗的希望之门
通过融合iPSC衍生的间充质干细胞与患者来源的胰腺癌细胞,创新生成的胰腺癌类器官,有效解决了化疗药物耐药性的问题,其中pFPCO甚至还表现出再增殖潜力,为胰腺导管腺癌这个癌中“王中王”患者的精准治疗提供了新思路。
由于肿瘤患者的个体差异与肿瘤异质性,标准化疗手段并非对全部患者有效,因此,需要开创新的治疗途径,给予患者更精准、更有效、更安全的肿瘤治疗,减轻其治疗痛苦和医药耗费。
而患者来源的肿瘤类器官组织正是这样的创新研究模型。作为体内肿瘤组织的体外3D“替身”,它可以高度模拟目标组织或器官的遗传和表观特征,保持原发肿瘤的异质性,成为科学家研究癌症生物学及抗癌药物药敏药筛的绝佳场所。
进入21世纪,随着细胞疗法和再生医学的深入人心,越来越多前沿医学技术逐步走向临床应用,将带来肿瘤类器官技术的全面进步,肿瘤类器官将以更精准的呈现,便于患者和医生做出临床决策,免于试药、耐药的痛苦及庞大的治疗费用压力,更多的肿瘤患者将因此受益。
Write in the last
写在最后
类器官以迅猛的态势迅速成为医学界的研究热点,而肿瘤类器官更是凭广阔的应用前景,成为研究重点之一。伴随再生医学领域的深入研究,肿瘤类器官在肿瘤生物学,基础研究及抗肿瘤药物筛选,药物敏感检测,疾病建模等方面显示出巨大的科研潜力。相信在不久的未来,技术突破将冲破传统肿瘤研究、诊疗的桎梏,为更多患者带来治疗曙光。
参考文献
[1] Kenta Takeuchi et al, Incorporation of human iPSC-derived stromal cells creates a pancreatic cancer organoid with heterogeneous cancer-associated fibroblasts, Cell Reports (2023). DOI: 10.1016/j.celrep.2023.113420
在近日落下帷幕的2024中国营养师发展大
以人工智能、大数据、云计算为代表的新一代
SITA收购IPS强化CUTE和CUSS
每年冬天,都会有一些意想不到的单品成为热
2024年11月5日至10日,第七届中国
在中国,为中国;在中国,为全球。2024
第七届上海国际进口博览会(简称“进博会”
香蕉娱乐至今成立近10年,主要从事经纪统
在数字化浪潮的汹涌推进下,云技术加速重塑
